Лабораторная работа: Получение коллоидных растворов
ЛАБОРАТОРНАЯ РАБОТА № 1
Опыт № 1. Получение коллоидных
растворов
Оборудование и реактивы: Химический стакан, пипетка,
дистиллированная вода, электрическая плитка, раствор хлорида железа (III) массовой
долей 5 %.
Ход работы: В химическом стакане на электрической плитке
нагревают воду до кипения. Затем в кипящую воду по каплям приливают немного
раствора хлорида железа (III). В кипящем разбавленном растворе гидролиз FeCl3 усиливается. Образуется гидроксид железа (III), который
не осаждаетсяна дно стакана: Fe3+ + 3 H2O ® Fe (OH)3 + 3H+.
В результате получается прозрачный коллоидный раствор
красно-коричневого цвета состава: {[Fe(OH)3]m , n Fe3+, 3(n-x)Cl-} 3xCl-.
Утилизация. К коллоидному раствору добавить несколько
капель соляной кислоты массовой долей 5 %. Полученный раствор хлорида железа
использовать в качестве реактива.
Опыт № 2. Прохождение луча света
через истинные растворы и коллоидные системы
Оборудование и реактивы: Коллоидный раствор гидроксида
железа (III), истинный раствор NaCl, фонарик, два
химических стакана, ящик с двумя отверстиями.
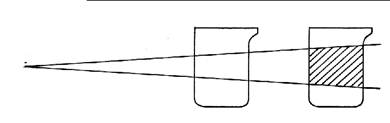
Рис. 1. Прохождение луча света через истинные и коллоидные
растворы.
Ход работы: В деревянный ящик ставят поочередно истинный
раствор NaCl и коллоидный раствор Fe(OH)3.
В отверстие ящика направляют луч света от фонарика. В другое отверстие сбоку наблюдают
прохождение луча света через растворы. Отмечают, что истинный раствор оптически
пуст, а через коллоидный раствор луч света проходит, оставляя «светлую
дорожку».
Утилизация. См. опыт № 1.
Опыт № 3. Окислительные свойства
хлора по отношению к бромид и иодид ионам
Вариант № 1.
Оборудование и реактивы: Пробирка с резиновыми вставками,
хлоркальциевая трубка с активированным углем, штатив, спиртовка, хлорная вода,
растворы KI и KBr массовой долей 5 %, раствор крахмала.
Ход работы: В пробирку (рис. 2.) наливаем
свежеприготовленной хлорной воды (1). Вставляем в пробирку приготовленные
резиновые кружочки- держатели (2) с отверстиями. В первый помещаем слой ваты,
смоченный раствором KI и крахмала (3), во второй – слой ваты, смоченный раствором
KBr
(4). Закрываем пробирку хлоркальциевой трубкой, заполненной углем (5).
Подогреваем хлорную воду в пробирке. Выделяющийся хлор реагирует с растворами KI и KBr.
Наблюдается изменение окраски: слой ваты с бромидом калия приобретает
красновато–коричневый цвет, вата с иодидом калия – синеет: 2KBr + Cl2 ® 2KCl + Br2, 2KI + Cl2 ® 2KCl + I2.
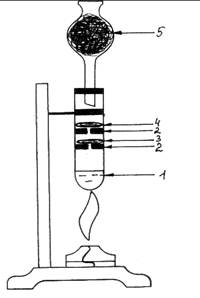
Рис. 2. Окисление хлором бромид и иодид ионов.
Техника безопасности: Установку мыть под вытяжкой, залив ее
предварительно щелочным раствором гидроксида кальция.
Утилизация. Промывные воды слить в емкость-нейтрализатор.
Вариант № 2.
Оборудование и реактивы: Пробирка Вюрца с пробкой, две U-образные
трубки, хлоркальциевая трубка с активированным углем, штатив, спиртовка,
спички, соляная кислота (конц.), KMnO4 (кристал.),
ложечка для сжигания, растворы KI и KBr массовой долей
5%.
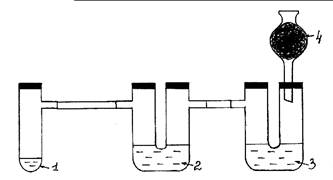
Рис. 3. Окисление хлором бромид и иодид ионов.
Ход работы: Собирают прибор согласно рис. 3. Установка
должна быть герметичной. В пробирку Вюрца (1) помещают одну или две ложечки для
сжигания кристаллического KMnO4 и соляную кислоту
(конц.), немного превышающую уровень соли. Пробирку быстро закрывают пробкой.
Выделяющийся хлор проходит сквозь толщу раствора KI в первой U-образной трубке (2). Наблюдают появление коричневой
окраски и образование темно- фиолетовых кристаллов. Далее хлор проходит через
раствор KBr во второй U–образной
трубке (3), окисляя анион брома соли. Раствор приобретает красновато-бурый
цвет. Излишки хлора поглощаются активированным углем в хлоркальциевой трубке
(4). Закончив опыт, установку переносят в вытяжной шкаф, где проводят
утилизацию растворов.
Техника безопасности: Концентрированную соляную кислоту
необходимого объема наливают в емкость в вытяжном шкафу, закрывают пробкой и
переносят на демонстрационный стол.
Утилизация. В первой по ходу хлора U–образной трубке
получают: 2KI + Cl2 ® I2 + 2KCl.
Кристаллы йода оседают через некоторое время на дно трубки,
а над осадком получается раствор йода в солевом растворе. Раствор йода слить в
склянку и использовать для обнаружения непредельных углеводородов. Кристаллы
йода промыть холодной водой, а затем растворить в спирте. Получают спиртовую
настойку йода. Если необходим кристаллический йод, то йод высушивают на
воздухе, затем переносят в склянку с плотно притертой пробкой. Во второй U–образной
трубке получают бром: 2KBr + Cl2 ® Br2 + 2KCl.
Бром находится в растворе образовавшейся соли. Слить
содержимое трубки в склянку. Использовать эту смесь для обнаружения непредельных
углеводородов, предварительно разбавив ее водой. Полученную бромную воду можно
использовать для демонстрации следующих окислительно-восстановительных реакций:
2NH3 + 3Br2 ® N2 + 6HBr;
H2S + Br2 ® S¯ + 2HBr;
Na2S + Br2 ® S¯ + 2NaBr.
После опытов слить растворы NaBr и HBr с осадка серы,
использовать раствор вновь для получения брома: 2NaBr + Cl2 ® 2NaCl + Br2. Утилизацию смеси KMnO4 и HCI cм. в теме: ”Галогены”. Все емкости споласкивают известковой
водой для поглощения галогенов, затем моют.
Опыт № 4. Окислительные свойства
хлора по отношению к сульфид и сульфит ионам
Оборудование и реактивы: Пробирка Вюрца, две U-образные
трубки, хлоркальциевая трубка с активированным углем, штатив, спиртовка,
спички, соляная кислота (конц.), KMnO4 (кристал.),
растворы: Na2S, Na2SO3, HCl массовой
долей 5 %, растворы NaOH и BaCl2 массовой долей 3%.
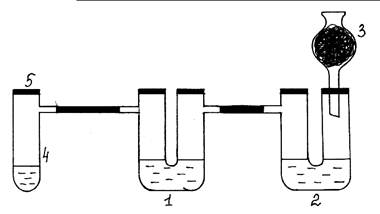
Рис.4. Окислительные свойства хлора по отношению к S 2- и SO32- ионам.
Ход работы: Собирают установку согласно рис. 4. В первую U–образную трубку
(1) наливают раствор Na2S, во вторую – раствор Na2SO3 и 0,5 мл раствора NaOH (2). Правое колено
второй трубки закрывают пробкой с хлоркальциевой трубкой, в которой находится
активированный уголь (3). В пробирку Вюрца (4) насыпают кристаллический KMnO4 (одну или две ложечки для сжигания), приливают
концентрированный раствор соляной кислоты немного выше уровня кристаллов соли и
быстро закрывают пробирку пробкой (5). Выделяющийся во время химической реакции
хлор проходит сначала в первую U-образную трубку. В толще раствора появляется сера. Затем
хлор поступает во вторую U-образную трубку. Чтобы доказать, что здесь образовался
продукт окисления – сульфат натрия, нужно внести раствор хлорида бария,
проткнув иглой шприца резиновую трубку, (образуется осадок белого цвета). Затем
добавить из шприца раствор соляной кислоты для растворения возможно
образовавшегося BaSO3. Если осадок не
растворяется, следовательно, в результате химической реакции хлор окисляет
сульфит-ион до сульфат-иона.
Уравнения реакций:
2KMnO4 + 16HCl ® 2MnCl2 + 5Cl2 + 8H2O + 2KCl;
Na2S + Cl2 ® S¯ + 2NaCl;
Na2SO3 + Cl2 +
2NaOH ® Na2SO4 + 2NaCl + H2O;
Na2SO4 + BaCl2 ® BaSO4¯ + 2NaCl;
Na2 SO3 + BaCI2 = BaSO3↓+
2NaCI
BaSO4¯ + HCl
--/®
BaSO3↓ + 2HCl ® BaCl2 + H2SO3; H2SO3
® SO2 + H2O.
Примечание: Чтобы взаимодействие KMnO4 с HCl шло энергичнее, можно пробирку немного подогреть.
Техника безопасности: Установку мыть под вытяжкой,
сполоснув предварительно емкости щелочным раствором.
Утилизация. В пробирке-реакторе получают хлор из
перманганата калия. Переработка этой смеси показана выше (тема “Галогены”, VIII кл.). В
первой на пути хлора U-образной трубке образуется сера. После эксперимента трубку
залить слабым щелочным раствором, дать отстояться сере, затем слить
надосадочную жидкость в кристаллизатор. Отделить серу фильтрованием, промыть и
высушить. Все промывные воды слить в раковину. Во второй U-образной
трубке идет процесс окисления сульфита натрия до сульфата.
Для обнаружения сульфат-анионов в трубку добавляется
раствор хлорида бария и соляная кислота. Образовавшуюся токсичную смесь слить
после опыта в емкость-нейтрализатор.
Опыт № 5. Окислительные свойства
азотной кислоты по отношению к сульфид и сульфит ионам
Оборудование и реактивы: Раствор HNO3 (1:1), растворы (5%) NaOH, Na2SO3, BaCl2, HCl, пробирки
демонстрационные, две пробки со стеклянными трубками и активированным углем.
Ход работы: 1) К раствору Na2S (0,5-1 мл)
добавить такой же объем раствора HNO3 (1:1). Пробирку
закрыть пробкой с активированным углем. Через некоторое время наблюдается
постепенное образование серы в толще раствора. Процесс идет без образования
токсичных газообразных продуктов восстановления азотной кислоты:
2HNO3 + Na2S ® S¯ + NaNO2
+ H2O + NaNO3.
2) К раствору Na2SО3 (0,5-1 мл) прилить такой же объем раствора HNO3, затем добавить 0,1 мл раствора щелочи. Процесс идет без
выделения токсичных газообразных продуктов восстановления азотной кислоты:
Na2SO3 + HNO3 +
NaOH ® Na2SO4 + NaNO2 +
H2O.
Для обнаружения полученного сульфата натрия через 1-2
минуты в пробирку добавить раствор BaCl2 и раствор HCl. Сохранение
осадка в кислой среде свидетельствует об образовании сульфат-иона в ходе реакции.
Утилизация: Содержимое пробирки (1) нейтрализуют после
опыта вначале суспензией, а затем раствором гидроксида кальция с фенолфталеином
до слабой малиновой окраски. Отфильтровать серу, промыть и высушить на воздухе.
Фильтрат сильно разбавляют и используют в качестве азотных удобрений на
пришкольном участке. В содержимое пробирки (2) в ходе опыта добавляют хлорид
бария с соляной кислотой. Получается смесь с токсичными соединениями бария,
поэтому жидкость с осадком переносят в емкость- нейтрализатор.
Опыт № 6. Эндотермические
реакции
Оборудование и реактивы: Прибор для электролиза, две
пробирки, два кристаллизатора, раствор NaOH (массовой долей 5-8
%), изогнутые газоотводные трубки, железные электроды.
Ход работы: Примером эндотермической реакции может стать
разложение воды электрическим током. Собирают установку согласно рис. 5. U-образную
трубку заполнить на 2/3 объема раствором NaOH, закрыть отверстия
трубки пробками с железными электродами.
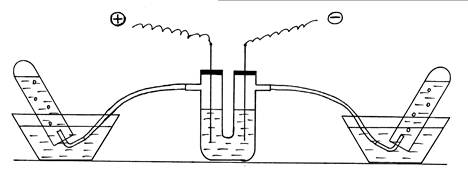
Рис. 5. Демонстрация эндотермической реакции разложения
воды.
Две пробирки наполняют дистиллированной водой и
опрокидывают вверх дном в кристаллизаторы с водой. В пробирки подводят
изогнутые газоотводные трубки от электролизера. Прибор подключают к источнику
тока. Наблюдают образование и накопление газов в пробирках (следует обратить
внимание на соотношение их объемов). Отключить внешний источник энергии,
реакция разложения заканчивается без подвода внешней энергии. Написать
уравнение электролиза раствора NaOH.
Утилизация. Раствор щелочи в U-образной трубке
использовать повторно, добавив более концентрированный раствор NaOH (контроль
по показаниям ареометра).
ЛАБОРАТОРНАЯ РАБОТА № 2
Опыт № 1. Получение комплексных
соединений
Оборудование и реактивы: Пробирки, разбавленные растворы: AlCl3, NaOH, AgNO3, NH4OH, NaCl, CuSO4, раствор NaCl насыщенный, NH4OH (конц.).
Ход работы: Провести химические процессы согласно
уравнениям реакций:
1). AlCl3 + 3NaOH
® Al(OH)3↓ + 3NaCl --- добавляют раствор щелочи в недостатке.
Al(OH)3↓
+ NaOH ® Na[Al(OH)4]
--- добавляют раствор щелочи в небольшом избытке.
2). AgNO3 + NH4OH ® NH4NO3 + AgOH↓ ---
добавляют в недостатке разбавленный раствор гидроксида аммония.
2AgOH↓® Ag2O + H2O --- наблюдают
частичное самопроизвольное разложение AgOH, смесь темнеет.
Ag2O + 4NH4OH ®2[Ag(NH3)2]OH + 3H2O -- добавляют
избыток концентрированного раствора гидроксида аммония. Получили «аммиачный
раствор оксида серебра».
3). AgNO3 + NaCI
® AgCl↓ + NaNO3 -- используют
предельно разбавленные растворы исходных веществ. Хлорид серебра должен
получиться в виде суспензии, а не творожистого осадка. К небольшой части этой
суспензии (0,5–1 мл) добавить избыток насыщенного раствора хлорида натрия.
Наблюдают растворение осадка:
AgCl↓ + NaCl
® Na[AgCl2 ]
Последняя реакция может проводиться на кафельной пластине.
4). CuSO4 + 2NH4OH ® Cu(OH)2↓ + (NH4)2SO4 --- добавляют
недостаток разбавленного раствора гидроксида аммония.
Cu(OH)2↓
+ 4NH3 ® [Cu(NH3)4](OH)2 – гидроксид тетраамминмеди (II); (добавляют
избыток концентрированного раствора аммиака).
Или: CuSO4 + 4NH3 ® [Cu(NH3)4]
SO4 --- сульфат
тетраамминмеди (II) синего цвета.
Утилизация. Полученный аммиакат меди оставить для
демонстрации опыта “Разложение перекиси водорода” в качестве катализатора.
Избыток аммиаката меди, накопленный в лаборатории, слить в стакан, добавить
малыми порциями раствор серной кислоты массовой долей 5-10% (Осторожно! Сильное
разогревание!). Происходит разрушение аммиаката, раствор приобретает голубую
окраску сульфата меди. Полученную смесь сульфата меди и сульфата аммония можно
использовать вновь для демонстрации получения аммиаката меди. Для этого следует
добавить в емкость раствор щелочи. После нейтрализации раствора кислоты,
система приобретает вновь синее окрашивание.
В пробирку с тетрагидроксоалюминатом натрия пропустить
углекислый газ, выпадает осадок Al(OH)3: Na[Al(OH)4] + CO2 = Al(OH)3↓
+ NaHCO3.
Осадок промыть и высушить. Аналогично утилизируют раствор Na2[Zn(OH)4] при получении комплексного соединения из
гидроксида цинка: Na2[Zn(OH)4]
+ 2CO2 = Zn(OH)2↓
+ 2NaHCO3.
Комплексное соединение серебра – аммиачный раствор оксида
серебра в дальнейшем использовать в качестве реактива для обнаружения
альдегидов. Дихлороаргентат натрия поместить в склянку для сбора
серебросодержащих остатков.
Опыт № 2. Каталитическое
разложение пероксида водорода в присутствии ионов меди, аммиаката меди и
каталазы
Оборудование и реактивы: Пробирки, раствор перекиси
водорода (10%), раствор сульфата меди (5%), раствор аммиаката меди, раствор
каталазы (мясная или картофельная вытяжка).
Ход работы: Для проведения опыта необходимо приготовить
растворы каталазы и аммиаката меди. Для приготовления каталазы необходимо
свежий мясной фарш залить водой, тщательно перемешать и отжать. Отжатую
жидкость профильтровать, фильтрат использовать для опыта. Для приготовления
аммиаката меди нужно к раствору сульфата меди (II) прилить избыток
концентрированного раствора аммиака:
CuSO4 + 4NH3 ®
[Cu(NH3)4] SO4 --- сульфат
тетраамминмеди (II).
В три пробирки с раствором перекиси водорода (по 1 мл)
добавляют: в первую – 0,2 мл раствора CuSO4, во вторую – несколько
капель раствора [Cu(NH3)4]
SO4, в третью – 0,2 мл
«раствора» каталазы. Наблюдают разную каталитическую активность веществ,
используемых в качестве катализаторов.
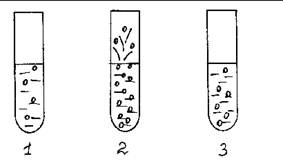
Рис. 6. Каталитическое разложение H2O2.
Техника безопасности. Не допускать попадания раствора
перекиси водорода на кожу и одежду. Осторожно добавлять аммиакат меди к
перекиси водорода. Реакция идет бурно.
Утилизация. Все растворы в пробирках перенести в
емкость–нейтрализатор.
Опыт № 3. Экзотермические
реакции
Оборудование и реактивы: Пробирка или железная банка,
сульфат меди (кристал.), железный порошок, вода, стеклянная палочка.
Ход работы: В пробирку или железную банку внести хорошо
перемешенные сульфат меди и железный порошок в соотношении количества вещества
1:1. Смесь смочить водой до кашицеобразного состояния и перемешать стеклянной
палочкой. Пробирка сильно нагревается за счет тепла экзотермической реакции:
CuSO4 + Fe ® FeSO4 +
Cu.
Утилизация. Растворить смесь в воде. Отфильтровать. Осадок
металлического железа с медью высушить, поместить в сухую склянку и герметично
закрыть пробкой. Смесью металлов можно воспользоваться для демонстрации
коррозии контакта Fe–Cu в нейтральной
или слабокислой среде.
Для этого: а) Немного смеси внести в пробирку с водой на 1
2 суток. Появляются бурые продукты коррозии:
А- ô Fe0 – 2 ē® Fe2+;
К+ ôСuô 2H2O + 4ē + O2 ® 4 OH-
Далее: Fe2+ + 2OH- ® Fe(OH)↓2; 4 Fe(OH)2↓
+ O2 + 2H2O ® 4Fe(OH)↓3.
б) Немного смеси внести в очень слабый раствор соляной
кислоты. Через некоторое время также образуется бурый осадок:
А- ô Fe0 – 2 ē® Fe2+; К+ ôCuô
2H+ + 2ē ® H2;
Далее: Fe2+ + 2Cl- ® FeCl2; 4FeCl2 + O2 + 2H2O ® 4FeOHCl2;
FeOHCl2 + 2H2O ® Fe(OH)3↓ + 2HCl.
После демонстрации опытов по коррозии слить все в раковину.
В фильтрат, содержащий растворы CuSO4 и FeSO4, (см. выше) внести железный предмет, например, хорошо
очищенный гвоздь. Далее утилизацию проводят по схеме, описанной в работе № 2,
опыт № 5, VIII класс.
Опыт № 4. Смещение химического
равновесия гидролиза NaHCO3
Оборудование и реактивы: Гидрокарбонат натрия, химический
стакан, вода, электрическая плитка, ложечка для сжигания.
Ход работы: В кипящую воду в химическом стакане прибавляют
ложечку кристаллического гидрокарбоната натрия. Происходят следующие процессы:
NaHCO3 ® Na+ + HCO-3 – диссоциация
HCO-3 + HOH ® H2CO3 + OH- - гидролиз аниона HCO-3
NaHCO3 + HOH ® NaOH + CO2 + H2O.
Повышение температуры оказывает влияние на смещение
химического равновесия гидролиза в сторону образования продуктов реакции CO2
и H2O. Бурное выделение газа свидетельствует о полном смещении
химического равновесия гидролиза NaHCO3. Объясните, почему
повышение температуры смещает равновесие гидролиза вправо?
Утилизация. Содержимое стакана со щелочным раствором
перенести в емкость–нейтрализатор.